Ecología de las enfermedades infecciosas
Las enfermedades infecciosas son importantes en ecología. Por ejemplo, tienen un papel fundamental en los ecosistemas, influyen en las abundancias de las poblaciones salvajes hasta el punto, en ciertos casos, de provocar extinciones de los huéspedes, y muy a menudo son factores determinantes de su evolución. La transmisión también está relacionada. ¿Te apetece descubrir más?

Mi artículo anterior pretendía demostrar que no tiene sentido que nos sorprenda la aparición de epidemias, ya que las ha habido siempre y las condiciones actuales aumentan el riesgo. Podèis encontrar un listado de epidemias a lo largo de la historia aquí. Aquí trataré de poner el tema en un contexto explícitamente ecológico.
Para empezar, las enfermedades debidas a parásitos patógenos siempre han tenido un papel en los ecosistemas. Influyen en las abundancias de las poblaciones salvajes hasta el punto, en ciertos casos, de provocar extinciones de los huéspedes, y muy a menudo como factores determinantes de su evolución. La transmisión depende de las características del patógeno y de las pautas de agregación, de comportamiento y organización social de los huéspedes. Estos temas son los que interesan en ecología. De la taxonomía y los ciclos de vida de los parásitos se ocupa la parasitología, mientras que el estudio de los factores de riesgo es cosa de los epidemiólogos (Kilpatrick, y Altizer, 2010).
Un estudio de caso: la peste bovina de África Oriental
Un ejemplo clásico de estudio ecológico de una enfermedad infecciosa es el de Sinclair y Norton-Griffith (1984). El libro comienza por la epidemia de peste bovina en África Oriental, a finales del s. XIX. La peste bovina es una enfermedad del ganado doméstico producida por un morbillivirus cercano al del sarampión. Aquella epidemia estalló a partir de 1884 con la llegada de los rebaños rusos del ejército del General Gordon a Kharthoum. Gordon luchaba con turcos y egipcios contra la rebelión de Muhammad Ahmad ibn as Sayyid abd Allah, que se hacía llamar El Mahdi, y sus derviches (El Mahdi es un mítico mesías árabe descendiente del profeta que ha de venir a dirigir la Tierra un tiempo antes del fin del mundo). Gordon fue asediado en Jartum y decapitado en 1885 (hay un film inglés de Basil Dearden, Khartoum, de 1966, con Charlton Heston como Gordon). El Mahdi murió seis meses después, de tifus. Las tropas anglo-egipcias de Lord Kitchener, en las que militaba el joven oficial Winston Churchill, retomaron Jartum trece años después.
La peste se expandió en 1890 en África Oriental y seis años después llegó al Cabo.

En 1992, el 95% del ganado había muerto. Los masai, que dependían del todo del ganado, sufrieron una hambruna terrible y su población se redujo a un tercio de la inicial. Mientras, morían también los búfalos, ñus y jirafas y mucha otra fauna salvaje, incluidos los depredadores que no encontraban presas. Aparecieron leones comedores de hombres. Uno solo de ellos mató a 89 personas (se hizo un filme con Michael Douglas, Los demonios de la noche, 1991, olvidable).
Los agricultores huyeron. Los pastos fueron invadidas por arbustos y árboles y la mosca tsé-tsé, portadora de la tripanosomiasis, encontró muchos más hábitats adecuados, lo que aún empujó más a la huida a los agricultores.

Hubo, en las tres décadas siguientes, varias oleadas de la peste. La recuperación no comenzó hasta 1925, cuando se observó la aparición de animales inmunizados, y en 1930 ya se dispuso de maquinaria para desbrozar y de vacunas para los rebaños. A partir de los años sesenta y setenta se produjo una reconstrucción espontánea de las sabanas.
En 1925 aparecieron animales inmunizados, a partir de los años sesenta y setenta se produjo una reconstrucción espontánea de las sabanas y en 2011 se erradicó la peste bovina.
La peste bovina fue del todo erradicada en 2011, siendo el segundo caso de una enfermedad infecciosa que se ha podido erradicar después de la viruela. Este ejemplo refleja las complejas repercusiones ecológicas de una epidemia, de la que fueron causa involuntaria los ejércitos coloniales y que afectaron a todo el ecosistema, incluidos los humanos. Y el estudio referido es un ejemplo de ecología de las enfermedades.
El uso de modelos
Hay una aproximación más teórica que la de este libro, que tiene precedentes notorios en los trabajos, primero de Kermack y McKendrick (1927) y, después, de Anderson y May (1979) o Gets y Pickering (1983) -por cierto, el australiano Robert May, que recibió el título de Baron May of Oxford, uno de los nombres destacados de la ecología del siglo XX, formado como físico y autor de trabajos destacados en el uso de modelos matemáticos y de la teoría del caos en ecología, murió a los 84 años este 28 de abril. Esta aproximación emplea modelos que derivan de los modelos clásicos de relaciones depredador-presa introducidos por Volterra y Lotka los años veinte, pero no voy a entrar en fórmulas (pero podéis ver el recuadro). En esencia, hay dos poblaciones, la del huésped y la del parásito, como ocurre en las relaciones depredador-presa. Según Anderson y May (1979) los parásitos pueden ser virus, bacterias, protozoos, helmintos y artrópodos. Tienen como hábitat otro organismo, al menos durante algún estadio de su ciclo de vida, y limitan el crecimiento de las poblaciones del huésped, sea planta o animal porque alteran la mortalidad, igual que los depredadores o las limitaciones ambientales. Pueden ser un factor decisivo en poblaciones de algunos mamíferos y parece que de manera más general, en aves.

Naturalmente, el tamaño del parásito es importante, porque los muy pequeños tienen generaciones de corta duración, tasas de reproducción muy elevadas y, en general, provocan respuestas inmunitarias, así que el tiempo de infección es corto comparado con la duración normal de vida del huésped. En cambio, los helmintos o artrópodos, mucho más grandes, viven más tiempo, se reproducen menos y las infecciones pueden perdurar sin que se produzca inmunización. En unos y otros hay muchos tipos diferentes de ciclos de vida que a veces pasan por huéspedes intermediarios, lo que complica los modelos. Además, la transmisión en la población de huéspedes puede ser entre individuos (horizontal) o de padres a hijos (vertical). Aquí hablaré sólo de los microparásitos y no de helmintos y artrópodos.

En los modelos clásicos llamados SIR se considera a la población del huésped como formada por S individuos susceptibles (pero no infectados), I infectados y R recuperados. El total de la población N = (S + I + R) y cada uno de estos grupos, además de depender de las tasas intrínsecas de nacimiento y mortalidad de la población, varían también en función de la acción de los parásitos, la cual depende de la su capacidad infectiva, de su efecto sobre la mortalidad y de la duración de la inmunidad. A partir de estas variables, Anderson y May proponen un sistema de tres ecuaciones diferenciales para la dinámica en el tiempo de las tres subpoblaciones S, I y R. El punto importante es que la propagación de la infección depende del grado de transmisión del parásito cuando entran en contacto individuos susceptibles e infectados, que quiere decir que las interacciones SI están afectadas por un factor de transmisión β: βSI. Este factor de transmisión β suele depender de la tasa de reproducción del parásito, de la dinámica del vector que lo transmite (p.e. mosquito, gotas de vapor emitidas, etc., pero a veces no hay vector, p.e. en la transmisión sexual), y de la tasa de invasión. El parásito regulará la población de huéspedes si la mortalidad que provoca es mayor que la diferencia entre nacimientos y muertes cuando no existe el parásito. Si la densidad de los S está por debajo de un cierto umbral, las infecciones disminuirán (un motivo para el confinamiento).
El Número básico de reproducción, un indicador de la velocidad de propagación difícil de calcular y usar
El número básico de reproducción R0 es el númeroe esperado de casos secundarios producidos por un solo individuo infectado en una población completamente susceptible. Es el producto de la transmisibilidad t (probabilidad de infección en cada contacto entre un individuo susceptible y uno infectado) por la tasa media de contactos entre susceptibles e infectados c (o sea contactos/tiempo) por la duración de la infectividad d (o sea, tiempo/infección). Si las fracciones correspondientes a cada categoría son s = S/N, i= I/N, r= R/N, el sistema de ecuaciones dará los valores de la variación con el tiempo de cada fracción, ds/dt, di/dt i dr/dt. Si llamamos β al producto tc y v a la tasa de immunización, el sistema será:
ds/dt = -βsi
di/dt = βsi – v
dr/dt = v
Se supone que todas las tasas son constantes.
La epidemia se produce si βsi – v > 0 y βsi/v> 1; al inicio, todos los individuos se pueden considerar susceptibles, o sea que s es aproximadamente 1 y tendremos R0 = β/v > 1
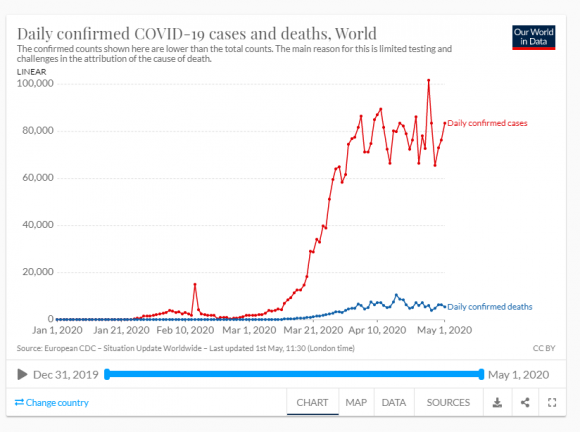
El valor de R0 es un indicador usado para valorar el estado de un proceso epidemiológico, pero su valor cambia con el tiempo y entre sitios para una misma enfermedad y hay que ser prudentes al usar los valores calculados. Hoy se cree que en España el COVID19 tiene un R0 próximo a 5.7, más del doble que una gripe normal o que el ebola, parecido al de las paperas o la tos ferina, la mitad que la varicela i menos de la mitad que el sarampión. Una vacunación eficaz ha de llegar a una proporción de 1 – 1/R0 de la población.
Pero no siempre hay un umbral. Getz y Pickering (1983) advirtieron que cada epidemia es única y que esto limita la utilidad de los modelos teóricos, que tienen que adaptarse sobre la marcha. Los modelos más modernos tienen presente que las transmisiones tienen lugar en un marco de redes de contacto: los huéspedes se reparten de manera irregular en el espacio y cada individuo tiene más probabilidades de contactar con cierto número de otros que con el resto (en los humanos, familia, amigos, colegas profesionales o usuarios del mismo medio de transporte a horas similares). Esta aproximación en red se distancia de los viejos modelos de Volterra y Lotka, de los que se decía que hacían bailar el ecosistema en la punta de una aguja: no tenían en cuenta el espacio y todos los individuos de presas y depredadores tenían igual probabilidad de encontrarse.

Ya se puede ver que es muy difícil conocer las variables y coeficientes de las ecuaciones: en el caso de la COVID19 no sabemos bien ni la capacidad infectiva, ni la duración de la inmunidad, ni el factor de transmisión, ni el umbral... Además, los modelos actuales deben tener presente que la susceptibilidad del huésped a la infección no es idéntica en todos los individuos. En la pandemia de COVID19 hemos tenido muy claro que, si bien todos los individuos se podían infectar (no los había inmunizados previamente, ni por haber pasado la enfermedad ni por haber sido vacunados, ya que no tenemos vacuna), que se desarrollara o no la enfermedad dependía de la edad y del estado de salud de cada persona. Esto vale también para otros animales y para plantas ante el ataque de una especie parásita o patógena. Por lo tanto, los modelos deberán dividir la subpoblación S en clases de susceptibilidad. Por otra parte, el riesgo de infección depende de otras cosas, como el aislamiento, como ya he dicho, y hay que tener siempre claro que no es la enfermedad lo que se transmite entre los individuos huésped, sino el parásito. En definitiva, los modelos para la actual pandemia no pueden ser muy fiables porque nos faltan muchos conocimientos todavía.
Dos modalidades de infección
A veces, la transmisión del patógeno aumenta con la densidad del huésped. Esto se conoce como transmisión dependiente de la densidad, o sea de la población total. Entonces, la transmisión sólo se produce por encima de un cierto umbral de densidad de huéspedes, lo que es importante para el control. Pero otras veces la densidad de huéspedes no afecta demasiado a la transmisión, la cual depende de la frecuencia, es decir de la proporción entre infectados y población total (I/ (S + I + R). En esta alternativa, no hay un umbral de población sino que la infección puede persistir con densidades muy bajas de los huéspedes. Estos dos casos se pueden considerar los extremos de toda una variedad de situaciones que se encuentran en la realidad. El COVID19 y otras infecciones de transmisión muy directa entre individuos se acercan más a la dependencia de la densidad, mientras que las infecciones sexuales como el SIDA y las que implican vectores como la malaria (los mosquitos) están más cerca de depender de la frecuencia.

Si hay dependencia de la densidad, los patógenos pueden llegar a regular las poblaciones de huéspedes en determinados casos (Kilpatrick y Altizer, 2010), pero es raro que causen su extinción. Existe, sin embargo, el efecto llamado Allee, que dice que la probabilidad de extinción es mayor cuando las poblaciones son pequeñas (en una población pequeña dispersa es difícil encontrar pareja para reproducirse), y, si una infección reduce mucho la población de una especie y esto se combina con el efecto Allee, se puede llegar a la extinción (Hilker, 2010): en función de cómo son las relaciones sociales y el comportamiento de los huéspedes, el efecto Allee puede ser fuerte (los osos polares podrían ser un ejemplo, Mólnard et al. 2008), y una epidemia puede desencadenar efectos catastróficos repentinos. Además, las infecciones tienen más efecto si el estado nutricional del huésped es malo (como les ocurre a los osos polares).

Una manera de luchar contra la infección dependiente de la densidad es el sacrificio de individuos. En mi primer Apunte hablé de la plaga de los olivos en Italia: lo que se hacía era talar olivos en un amplio frente ante el progreso de la epidemia. En enfermedades humanas, se emplea la cuarentena para reducir las aglomeraciones y los contactos, pero en la historia también hay ejemplos de eliminación de personas enfermas (sobre todo para evitar que traten de huir de su aislamiento). Las vacunas se aplicarán a una proporción suficiente de la población y son útiles no sólo para los vacunados: los individuos susceptibles tienen menos probabilidades de ser infectados si están rodeados de individuos vacunados. Se sabe que, normalmente, una parte pequeña de individuos son causantes de la mayor parte de infecciones, así que conviene detectar a estos individuos y aislarlos.
El COVID19 parece que, por suerte, no infecta a los animales domésticos, (sólo se conoce algún caso en gatos), pero en la peste negra además de los humanos intervienen como mínimo las ratas y las pulgas de las ratas. Esto complica las cosas. El ejemplo de la peste bovina sería un caso en el que hay muchos huéspedes. En infecciones dependientes de la frecuencia, si hay muchos huéspedes se puede producir un efecto de dilución que amortigua el impacto de la epidemia (Keesing et al. 2006), pero alguna especie concreta puede resultar afectada de manera catastrófica.
Aspectos evolutivos
Una pregunta clásica es por qué los parásitos hacen daño, e incluso destruyen a sus huéspedes, cuando su vida depende de ellos (Anderson & May 1982, Read 1994). Por un lado, dado que los patógenos entran en los tejidos del huésped y se nutren de ellos o de sus recursos para mantenerse o reproducirse, algún daño resulta inevitable. Según una teoría, sólo confirmada en algunos casos, la selección natural descarta a los parásitos extremadamente virulentos que se reproducen tan rápido que matan al huésped antes de encontrar otro; igualmente, los que se reproducen demasiado despacio tienen problemas para ser transmitidos a tiempo. Es mejor para los parásitos tener unas tasas de reproducción intermedias que den tiempo a la transmisión antes de la muerte del huésped. La cuestión de la virulencia es importante. Si la enfermedad es muy virulenta, los huéspedes mueren muy rápido y la transmisión se interrumpe pronto. Son los patógenos de virulencia media los que tienen más efectos a largo plazo sobre las poblaciones de huéspedes y sobre el conjunto de los ecosistemas.
También los huéspedes están sujetos a evolución frente a los parásitos. Hay dos estrategias posibles, la de tolerancia y la de resistencia. En la primera, el huésped tiende a reducir los daños pero deja que el parásito se reproduzca y se transmita. En la de resistencia, el huésped puede desarrollar mecanismos para reducir la probabilidad de ser infectado, o la de que el parásito se reproduzca en su interior, o para recuperarse eliminando rápidamente al parásito. Parece que la estrategia de resistencia debería prevalecer, pero el huésped tiene que encontrar un compromiso entre varias necesidades y los parásitos pueden evolucionar en contra de las adaptaciones de resistencia del huésped, así que no hay respuestas sencillas. Lo que tenemos es un proceso co-evolutivo según un modelo de Tom y Jerry: A cada invento del huésped sucede uno del parásito y viceversa. El resultado será, finalmente, la existencia de muchos genotipos de huéspedes y de parásitos y sólo algunas combinaciones huésped-parásito darán lugar a infección. Huelga decir que los cambios ambientales pueden alterar esta relación.
Enfermedades infecciosas y ecosistemas
Hemos visto en la introducción que una enfermedad infecciosa puede alterar todo un ecosistema. Asimismo, la emergencia de enfermedades puede depender de las alteraciones del ecosistema. En el caso de la peste bovina, la alteración del hábitat provocada por la peste favorecía la expansión de otra enfermedad, la tripanosomiasis ... y también la de situaciones de hambre que afectaban a la mortalidad de algunas especies, incluidos los humanos. Para este tema de los procesos ecosistémicos en relación a la salud, recomiendo la consulta del capítulo 14 del Millenium Assessment (Amerasinghe et al. 2004) y el documento de la Wildlife Conservation Society (WCS) en pdf, de abril de este año.
Una enfermedad infecciosa puede alterar mucho todo un ecosistema. Asimismo, la emergencia de enfermedades puede depender de las alteraciones del ecosistema.
En el primer encontraréis ejemplos de asociaciones entre transformaciones del medio por la actividad humana, enfermedades infecciosas y aumento de la resistencia a los antibióticos. Se señala que las zonas de frontera con ecosistemas naturales y zonas urbanas o agrícolas son a menudo propicias a la transferencia de patógenos y vectores. Cuando la frontera esta entre zonas urbanas y bosques tropicales encontramos malaria, fiebre amarilla y dengue, y hay fiebres hemorrágicas en los límites entre bosques tropicales y zonas agrícolas. El kala-azar o la peste son más propios de zonas secas, la leishmaniasis cutánea lo es de zonas forestales. Las enfermedades prioritarias son la malaria en muchos ecosistemas, la esquistosomiasis, la filariasis linfática y la encefalitis de Japón en zonas tropicales cultivadas y de humedales interiores, el dengue en ciudades, la leishmaniasis y la enfermedad de Chagas en zonas forestales y tierras áridas, la meningitis en el Sahel, el cólera en sistemas litorales, aguas dulces y sistemas urbanos y el virus del Nilo occidental y la enfermedad de Lyme en sistemas urbanos y suburbanos de Europa y Norteamérica.
La alteración de hábitats altera el número de sitios de cría de los vectores o la distribución de los huéspedes que son reservorio de patógenos, las transferencias a otros huéspedes, las pérdidas de depredadores y cambios en las poblaciones de huéspedes, el incremento de resistencia y la contaminación.
El riesgo de alterar la incidencia de estas enfermedades, nos dice este informe que ya tiene 14 años, aumenta con la destrucción e invasión de hábitats salvajes para talas y construcción de carreteras, cambios en la disponibilidad y distribución de aguas superficiales y construcción de embalses, regadíos o desviación de ríos, aumento del uso ganadero o agrícola, deposición de contaminantes químicos (abonos, plaguicidas), diseminación urbana, alteración del clima, migraciones y aumento de desplazamientos y del comercio internacionales e introducciones accidentales o no de patógenos por los humanos. Los proyectos de desarrollo pueden reducir el riesgo de infecciones con medidas de gestión y protección. Hay que tener en cuenta que la alteración de hábitats cambia el número de sitios de cría de los vectores o la distribución de los huéspedes que son reservorio de patógenos, las transferencias a otros huéspedes, provoc pérdidas de depredadores y cambios en las poblaciones de huéspedes, el incremento de resistencia (observada en mosquitos a los plaguicidas y en bacterias a los antibióticos) y la contaminación. Los embalses y canales son hábitats para caracoles, huéspedes intermediarios de la esquistosomiasis; los arrozales aumentan las áreas de cría de los mosquitos que transmiten malaria, filariasis linfática, encefalitis de Japón y fiebre del Rift-Valley; la deforestación aumenta el riesgo de malaria en África y Sudamérica. No es menos cierto que la destrucción de ciertos hábitats favorables a los mosquitos elimina riesgos. Todo esto se sabe, pues, hace tiempo, pero ahora a la mayoría, no sólo de la gente sino de los gestores públicos, les coge por sorpresa.

Según la OMS, las enfermedades infecciosas suponen una cuarta parte del total de enfermedades (en África, cerca del 50% de la población las sufre) y algunas de las antes mencionadas están en expansión, al tiempo que aparecen otras nuevas. Sabemos que algunas, como la tuberculosis, el sarampión y la viruela, son zoonosis, nos vinieron de la domesticación de ganado. Muchos patógenos que se propagan de persona a persona proceden de zoonosis pero han evolucionado en la relación con nosotros y algunos virus incluso se han incorporado a nuestro genoma y se han convertido en enfermedades genéticas. Los muy rápidos cambios ambientales, demográficos y de transporte de los dos últimos siglos han contribuido a la emergencia de nuevos patógenos. De las enfermedades infecciosas humanas, sólo la viruela ha sido erradicada. Las enfermedades causadas por patógenos que viven parte del tiempo en medios externos a las personas, como el agua u organismos vectores, son las que más han sido influidas por los cambios ambientales. La lucha contra las enfermedades infecciosas pide un gran conocimiento de la biología de los patógenos, de los vectores y de los huéspedes, así como de las condiciones del medio. Según Carroll et al. (2018), los virus que sabemos que infectan a humanos son menos de 300, pero hay estimaciones que dicen que, en las mismas 25 familias víricas de riesgo, en aves y mamíferos, podrían haber del orden de 700.000 virus potencialmente zoonóticos sobre un total de 1.7 millones.
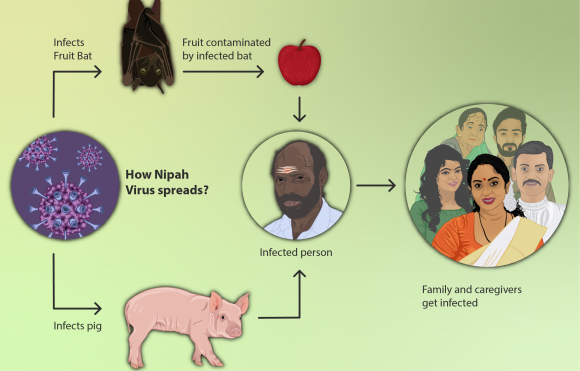
Se consideran enfermedades emergentes las que han incrementado su incidencia o el área de distribución (como la enfermedad de Lyme, la tuberculosis, los virus del Nilo Occidental y Nipah), que han evolucionado (como nuevas variantes de gripe, SARS o formas de malaria resistente a los medicamentos), o que se han descubierto recientemente (virus de Hendri o del ébola, COVID19), etc. El Millenium nos cuenta que, con demasiada frecuencia, las grandes inversiones en embalses y regadíos han tenido pros y contras en términos de coste-beneficio, y una parte significativa de los contras se relaciona con la expansión de enfermedades infecciosas. Esto sólo es un ejemplo de cómo se alteran aspectos de salud con las transformaciones ambientales y el aumento del transporte horizontal de personas y cosas, porque se alteran ciclos de vida, probabilidades de contagio, lugares de cría, invasiones biológicas, tasas evolutivas , etc.
Demasiado a menudo, las grandes inversiones en embalses y regadíos han tenido pros y contras en términos de coste-beneficio, y una parte significativa de los contras se relaciona con la expansión de enfermedades infecciosas.
Hay más de 1400 especies patógenas para los humanos. De ellas, el 61% son zoonóticas. Pues bien, las zoonóticas son el 75% de las enfermedades infecciosas emergentes. Se trata a menudo de virus que pasan de un animal a los humanos y evolucionan en nuevas formas. Por este motivo, no tenemos herramientas de lucha, como vacunas o fármacos, y por eso son tan peligrosos: fue el caso del SIDA, y lo es del ébola, la enfermedad del Nipah, el hantavirus, nuevos virus de la gripe... entre ellos los que vienen de pájaros, como el H5N1, que originó mucha preocupación y provocó que la OMS hiciera una campaña para la vacunación masiva contra el H1N1 de la gripe de 2009-10 (que sólo causó al final 12.000 muertos y que, lamentablemente, estimuló los movimientos anti-vacunas, que consideraron que la alarma sólo era un intento de hacer dinero de ciertas empresas farmacéuticas). Una gripe aviar, H7N9, fué detectada en 2013 en China y había infectado a algunas personas en contacto con pájaros. Se sabe que se necesitan muy pocas mutaciones para el paso de estos virus de las aves a los mamíferos. En el caso de la enfermedad de las vacas locas, que se transmite a los humanos, la causa es una proteína rara, conocida como prión, y se desencadena al aumentar las proteínas en el alimento de las vacas usando residuos de cerebros y médulas de vacas y ovinos, cuando todo el mundo sabe que las vacas son herbívoras y cuando en ovejas y humanos se conocían enfermedades similares (el kuru en caníbales de Nueva Guinea, que es la enfermedad de Creutzfeldt-Jakob).
El SARS es un virus aparecido en los mercados de animales vivos chinos (mercados húmedos), conocidos como fuente de virus de la gripe desde los años 1970, con huéspedes intermediarios en murciélagos, civetas de palmera (Paguna larvados), mapaches asiáticos (Nyctereutes procuyoinboides) y tejones chinos (Melogale moschata). Es un precedente claro del virus COVID19, como también lo es el MERS.

Sobre el riesgo de epidemias en una población humana creciente, véase Gholipour (2013). Los cálculos demográficos pronostican que la población humana llegará a 9600 millones en 2050 y a 11000 millones en 2100. El ecólogo Peter Daszak (comentando un trabajo de su equipo, Jones et al. 2008) dijo que había una fuerte correlación entre el riesgo de pandemias y la densidad de la población humana y que el número de enfermedades infecciosas emergentes había aumentado significativamente (del orden de 300 nuevas entre 1940 y 2004, unas por zoonosis y otras por aparición de variedades resistentes a los tratamientos), a pesar de la mejora de las técnicas de diagnóstico y vigilancia. Vieron que todas las nuevas enfermedades se asociaban a un crecimiento repentino de la población humana, nuevas actividades en el medio y presencia de alta diversidad de fauna salvaje en el lugar de origen del patógeno. Morand et al. (2014) encuentran que, a pesar de que la biodiversidad es una fuente de patógenos, donde más problemas se han producido es allí donde hay más especies en riesgo de extinción y más pérdida de superficie forestal y creen que, si está bien preservada, la biodiversidad podría funcionar como un seguro contra los brotes epidémicos, pero que hace falta mucha investigación para confirmar los resultados a nivel regional y local con el fin de que el planeamiento pueda integrar objetivos de gestión de la biodiversidad y de mejora de la salud.
Aunque la biodiversidad es una fuente de patógenos, donde más problemas se han producido es allí donde hay más especies en riesgo de extinción y más pérdida de superficie forestal y creen que, si está bien preservada, la biodiversidad podría funcionar como un seguro contra los brotes epidémicos.
Es de esperar que la crisis económica que ya tenemos no comporte recortes en sanidad, después de la experiencia, pero convendría que tampoco los hubiera en investigación biomédica y ecológica, dado que hay tanto que todavía no sabemos sobre aspectos de la ecología que condicionan la prevención y la lucha ante enfermedades infecciosas emergentes.
Demócrito de Abdera dijo que la naturaleza se basta a sí misma y que por eso vence, con lo menos y lo seguro, los excesos de la esperanza. Isaac Asimov nos aconseja: si el conocimiento puede crear problemas, no es con la ignorancia como los resolveremos.
Referencias
F.P. Amerasinghe et al. 2004. Human Health: Ecosystem Regulation of Infectious Diseases. Millenium Assessment. https://www.millenniumassessment.org/documents/document.283.aspx.pdf
Anderson, R.M., R.M. May. 1979. Population biology of infectious diseases: Part !. Nature 280: 361-367.
Carroll et al. 2018. The Global Virome Project. Science. 359: 872–874. doi:10.1126/ science.aap7463
Jones, K.E., N.G. Patel, M.A. Levy, A. Storeygard, D. Balk, J.L. Gittleman, P. Daszak. 2008. Global trends in emerging infectious diseases. Nature 451. doi:10.1038/nature06536
Getz, W., J. Pickering. 1983. Epidemic models- Thresholds and population regulation. The Am. Nat. 121(6):892-898
Gholipour, B. 2013. What 11 billion mean for disease outbreaks, Scientific American, novembre
F.M. Hilker. 2010. Population collapse to extinction: the catastrophic combination of parasitism and Allee effect. Journal of Biol. Dynamics, 4: Workshop on population dynamics and mathematical biology, Luminy, France, june 2008
Kermack, W. O., A.G. McKendrick. 1927. A contribution to the mathematical theory of epidemics. Proceedings of the Royal Society A, 115 (772), 700–721.
Kilpatrick, A. M., S. Altizer. 2010. Disease Ecology. Nature Education Knowledge 3(10):55).
Molnár, P.K., A-E_ Derocher, M-A- Lewis, M.K. Taylor. 2008. Modelling the mating System of polar bears: a mechanistic approach to the Allee effect. Proc. Biol. Soc. 275: 217-226,
Morand, S., S. Jittapalapong, Y. Suputtamongkol, M.T. Abdullah, T.B. Huan. 2014. Infectious Diseases and Their Outbreaks in Asia-Pacific: Biodiversity and Its Regulation Loss Matter. PLoS ONE 9(2): e90032. https://doi.org/10.1371/journal.pone.0090032
Read. A. F. 1994. The evolution of virulence. Trends in Microbiol. Pp.73-76-
Sinclair, A.R.E., M. Norton-Griffith. 1984. Serengeti: Dynamics of an ecosystem. The Chicago Univ. Press, Chicago i Londres








